
- Autor Stanley Ellington [email protected].
- Public 2023-12-16 00:15.
- Viimati modifitseeritud 2025-01-22 15:58.
Kliiniliste uuringute taotlus ( CTA ) on taotlus/esitus pädevale kodanikule. Reguleerivad Asutus(ed), mis annab loa kliinilise uuringu läbiviimiseks konkreetses riigis. Näited. esildised pädevale riigile Reguleerivad Võimude hulka võivad kuuluda, kuid mitte ainult: 1.
Mis on sellega seoses kliinilistes uuringutes CTA?
A Kliinilises uuringus Kokkulepe ( CTA ) on õiguslikult siduv leping, mis haldab suhet sponsori vahel, kes võib pakkuda Uuring ravim või seade, rahaline toetus ja/või omandiõigusega kaitstud teave ning asutus, mis võib andmeid ja/või tulemusi pakkuda, avaldada, sisestada
Samamoodi, kes kiidab Ühendkuningriigis heaks kliinilised uuringud? Kohtuprotsess autoriseerimine Kõik Kliinilistes uuringutes ravimite ja meditsiiniseadmetega seotud uuringute jaoks peab samuti olema loa organisatsioon nimega Medicines and Healthcare Products Regulatory Agency (MHRA). Seda nimetatakse Kliinilises uuringus Autoriseerimine (CTA).
Seejärel tekib küsimus, mis on CTA ravimites?
Kliiniliste uuringute kinnitused ( CTA ); (IND) Protseduur hõlmab EudraCT numbri saamist Euroopa Ravimiametist (EMA) ja kliinilise uuringu loa taotluse esitamist ( CTA ) iga liikmesriigi pädevale asutusele, kus uuring läbi viiakse.
Kas Inds on heaks kiidetud?
IND ei ole turundusrakendus heakskiit . See on tee, mille kaudu sponsor saab toidu- ja ravimiametilt (FDA) erandi föderaalseadusest, mis keelab heakskiitmata ravimi transportimise üle osariigi piiride.
Soovitan:
Mis on ettevõte, mis kuulub eraisikule ja mida juhib?

Füüsilisest isikust ettevõtja. Ettevõte, mida haldab ja haldab üksikisik
Mis on ERP MIS -is?

ERP (Enterprise Resource Planning) on arvutisüsteem, mis vastutab tootmise, müügi, turunduse, laoseisu, raamatupidamise, personali ja rahanduse juhtimise eest. Ehk teisisõnu, see on juhtimisinfosüsteem (MIS), mis töötab ettevõtte ressursside andmetega. ERP-süsteemide põhifunktsioonid: Raamatupidamine
Mis on CAM-tehased ja mis on nende eelised?

Crassulacean Acid Metabolism (CAM) eeliseks on see, et see kõrvaldab päeva jooksul sisuliselt aurustumist läbi taimede stomata (veekadu gaasivahetuse kaudu), võimaldades CAM-taimedel ellu jääda ebasoodsas kliimas, kus veekadu on taimede kasvu peamiseks piiravaks teguriks
Mis on agiilne MIS-infrastruktuur?
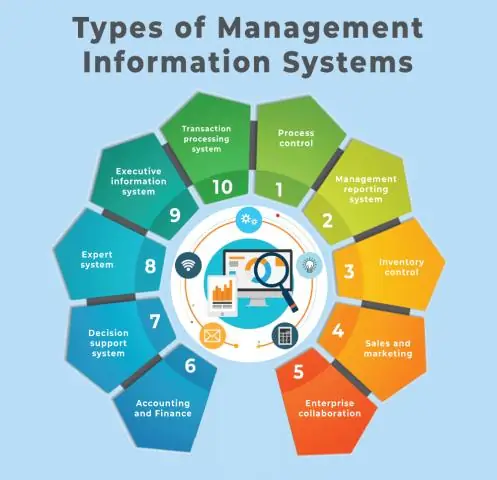
Agile MIS Infrastructure on organisatsiooni riistvara, tarkvara ja telekommunikatsiooniseadmete kombinatsioon, mis kõik töötavad koos süsteemina, et toetada selle organisatsiooni eesmärke. Kaasaskantavus – see on rakenduse võime töötada mis tahes seadmel või tarkvaraplatvormil
Mis on CTA farmaatsias?

Kliiniliste uuringute heakskiidud (CTA); (IND) Protseduur hõlmab EudraCT numbri saamist Euroopa Ravimiametilt (EMA) ja kliinilise uuringu loa (CTA) taotluse esitamist iga selle liikmesriigi pädevale asutusele, kus uuring läbi viiakse
